Гипопластическая анемия
– заболевание крови, характеризующееся снижением кровообразовательной функции костного мозга.
Гипопластические и апластические анемии связаны с нарушением кроветворящей функции костного мозга, но между ними есть и различия.
Симптомы гипопластической анемии
Выделяют несколько типов заболевания:
— Подострая гипопластическая анемия;
— Хроническая гипопластическая анемия;
— Хроническая гипопластическая анемия с гемолитическим компонентом;
— Парциальная гипопластическая анемия.
Для хронической гипопластической анемии характерно длительное течение с периодическими обострениями. Такой тип заболевания вызывает у больного слабость, повышенную утомляемость, одышку, учащенное сердцебиение.
У больных гипопластической анемией с гемолитическим компонентом может появиться желтый оттенок бледной кожи.
Диагностика гипопластической анемии
Диагноз ставится на основании анамнеза жизни и осмотра пациента, симптомов и лабораторных исследований.
Анализ крови выявляет снижение количества ретикулоцитов, тромбоцитов, эритроцитов. При биохимическом анализе крови наблюдается повышенное количество сывороточного железа.
Исследование костного мозга показывает уменьшение клеток эритроцитарного и гранулоцитарного рядов и лимфоцитов. Иногда наблюдается опустошение костного мозга и увеличение в нем количества железа.
Апластическая анемия
Апластическая анемия является тяжелым заболеванием крови, при котором развивается угнетение всех ростков костного мозга. Причины заболевания различные – от генетической предрасположенности до вредоносного действия ионизирующего излучения и различных химических соединений. Клинически заболевание проявляется анемическим, тромбоцитопеническим синдромом, а также выраженными инфекционными осложнениями. Диагноз выставляется исходя из клинической картины, анализов крови и пункции костного мозга.
Что такое апластическая анемия?
Апластическая анемия является патологическим состоянием организма, при котором снижается количество всех трех типов клеток крови (эритроцитов, лейкоцитов и тромбоцитов) вследствие замедления или полного прекращения образования их в костном мозге. По происхождению апластические анемии делятся на:
- врожденные;
- приобретенные.
В большинстве случаев наблюдается угнетение всех трех ростков кроветворения, однако клинически замечено, что в различные фазы болезни может наблюдаться более выраженное угнетение какого-то одного из ростков
По преимущественному поражению костномозговых ростков выделяют:
- угнетение одного кроветворного ростка (эритроцитарного, лейкоцитарного или тромбоцитарного);
- угнетение двух кроветворных ростков;
- угнетение трех кроветворных ростков.
Причины апластической анемии
Причины апластической анемии различаются при врожденной и приобретенной анемии.
Различают следующие причины приобретенных апластических анемий:
- ионизирующее излучение;
- лекарственные препараты (декарис, анальгин, левомицетин, тетрациклин, бутадион и др.);
- химические соединения (пестициды, бензол);
- заболевания (вирусные гепатиты А, В и С, вирус Эпштейн-Барр, цитомегаловирус, вирус герпеса, ВИЧ, парвовирус В19 и др.).
- гормональные нарушения со стороны яичников, щитовидной шелезы и вилочковой железы.
Некоторые вредоносные агенты непосредственно воздействуют на костный мозг (ионизирующее излучение, химические и лекарственные вещества). Иные воздействуют опосредованно через аутоиммунные механизмы (вирусный гепатит В).
Диагностика апластической анемии
Клиническая картина заболевания может в значительной степени ориентировать врача в направлении анемии, однако диагноз должен быть подтвержден или опровергнут при помощи лабораторных анализов и параклинических исследований. Наиболее ценными дополнительными исследованиями являются:
- общий анализ крови (ОАК);
- биохимический анализ крови (БАК);
- стернальная пункция;
- трепанобиопсия.
Общий анализ крови
Данные общего анализа крови при апластической анемии свидетельствуют в пользу панцитопении (снижение количества всех трех типов клеток костного мозга). Уменьшение количества лейкоцитов наблюдается преимущественно за счет снижения гранулоцитов (нейтрофилы, эозинофилы и базофилы). Таким образом, относительно увеличивается процент лимфоцитов и моноцитов в лейкоцитарной формуле. На различных стадиях заболевания могут быть выявлены воспалительные признаки в той или иной мере. Ориентировочными показателями ОАК при апластической анемии являются:
Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
Эритроциты – 0,7 – 2,5 х 1012\л (норма 3,7 х 1012\л). Снижение количества зрелых эритроцитов.
Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
Тромбоциты – менее 35 промилле или 100 х 109\л. Снижение количества тромбоцитов.
Лейкоциты – 0,5 – 2,5 х 109\л (норма 4 – 9 х 109\л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
Анизоцитоз – наличие в крови эритроцитов различного размера.
Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Биохимический анализ крови
Некоторые виды биохимических анализов крови могут акцентировать внимание врача на отклонениях в организме, которые косвенно вписываются в три вышеперечисленных анемических синдрома. Ориентировочными показателями БАК при апластической анемии являются:
Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Стернальная пункция
Данный вид исследования используется с целью визуализации клеток костного мозга и их процентного соотношения. При апластической анемии миелограмма будет скудной, количество клеточных элементов значительно снижено. Камбиальные клетки эритроцитарного и лейкоцитарного ряда единичны или отсутствуют. Мегакариобласты отсутствуют. В редких случаях при пункции случается встретить сгруппированные очаги повышенной пролиферации клеток как компенсаторную реакцию здорового костного мозга на анемию. Такая миелограмма может сбить с толку, поскольку будет свидетельствовать в пользу отсутствия апластической анемии и поэтому будет ложноотрицательной.
Трепанобиопсия
Трепанобиопсия является способом изъятия части костного мозга из крыла подвздошной кости пациента. Преимущество данной процедуры над стернальной пункцией заключается в возможности забора большего количества материала с сохранением его структуры. Большее количество материала уменьшает вероятность ложноотрицательного результата апластической анемии, а изучение структуры костного мозга позволяет помимо цитологического исследования (миелограммы) провести еще и гистологическое. При помощи анализа крови и результатов трепанобиопсии возможно определение степени тяжести апластической анемии.
- Апластическая анемия средней тяжести определяется следующими показателями:
гранулоциты менее 2,0 х 109\л;
тромбоциты менее 100 х 109\л;
ретикулоциты менее 2 – 3%;
гипоплазия костного мозга на трепанобиопсии.
- Апластическая анемия тяжелой степени определяется следующими показателями:
гранулоциты менее 0,5 х 109\л;
тромбоциты менее 20 х 109\л;
ретикулоциты менее 1%;
аплазия костного мозга на трепанобиопсии.
- Апластическая анемия крайне тяжелой степени определяется следующими показателями:
гранулоциты менее 0,2 х 109\л;
тромбоциты единичные или отсутствуют;
ретикулоциты единичные или отсутствуют;
аплазия костного мозга на трепанобиопсии.
Прогноз при апластической анемии
Прогноз при апластической анемии во многом зависит от сроков обнаружения заболевания. При раннем обнаружении существует возможность более активного вмешательства в течение заболевания. При более позднем обнаружении шансы на излечение уменьшаются. Врожденная апластическая анемия Фанкони в большинстве случаев крайне тяжело поддается лечению, поскольку костный мозг никогда не был здоровым и, соответственно, очень сложно восстанавливается. Наличие врожденных аномалий развития сильно ограничивает показания к пересадке костного мозга таким пациентам. В большинстве случаев больные погибают в детском возрасте от аномалий развития или инфекционных осложнений. Приобретенные апластические анемии имеют более благоприятный прогноз, поскольку в некоторых случаях являются обратимыми после прекращения действия повреждающего фактора на костный мозг.
Врач лабораторной диагностики
Новополоцкой городской больницы
Костюк К.С.
Лечение гипопластической анемии
До конца излечить гипопластическую анемию нельзя, но лечебная терапия позволяет увеличить продолжительность жизни пациентов.
Проводится лечение основного заболевания, вызвавшего гипопластическую анемию, а также устраняются факторы, спровоцировавшие ее.
Пациентам проводят переливания эритроцитарной и тромбоцитарной массы. Также назначается курс витаминов группы В, аскорбиновая кислота, рутин, хлорид кальция. Возможно проведение гормонотерапии кортикостероидами, которые продлевают срок жизни эритроцитов и снижают реакцию организма на переливание крови.
Операционное лечение подразумевает удаление селезенки, благодаря чему снижается депрессивное влияние на костный мозг и уровень разрушения эритроцитов. В некоторых случаях прибегают к пересадке костного мозга, но для этого необходимо тщательно выбрать донора.
Прогноз гипопластической анемии неблагоприятный при остром и подостром течении заболевания. В остальных случаях лечебная терапия снижает процент летальных исходов и увеличивает качество жизни больных.
Анемии, патология гемостаза, онкогематология
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Апластическая анемия (АА) – заболевание, являющееся следствием исчезновения или резкого уменьшения в костном мозге полипотентных стволовых клеток, количество которых снижается до 1% и ниже, что приводит к опустошению или аплазии костного мозга. Морфологически это проявляется панцитопенией в анализах периферической крови, отсутствием кроветворных клеток в пунктате костного мозга.В крови панцитопения характеризуется лейкопенией за счет нейтропении с относительным лимфоцитозом, отсутствием ретикулоцитов. При обнаружении таких изменений необходимо обязательно исключить все возможные причины аплазии (вирусные инфекции, злокачественные заболевания, заболевания крови (лимфопролиферативные заболевания), системные коллагенозы, контакт с химическими веществами, радиация), у взрослых провести трепанобиопсиюдля гистологического исследования костного мозга.
АА впервые была описана Эрлихом в 1888 году. Частота АА составляет 2 – 4 случая на 1 млн. населения в США и Европе, тогда как в некоторых странах Восточной Азии АА встречается значительно чаще. Так, в Таиланде и Японии заболеваемость АА составляет 11 – 14 случаев на 1 млн. населения.
АА наиболее часто выявляется в двух возрастных группах: 20 – 25 лет и старше 60 лет. Статистически значимая разница в частоте заболеваемости между мужчинами и женщинами отсутствует.
Этиология и патогенез
АА могут быть врожденными, но чаще носят приобретенный характер. Врожденные, генетически обусловленные АА впервые были описаны Фанкони в 1927 году.
Врожденные АА клинически проявляются недостаточностью костного мозга в первые годы жизни ребенка и нередко сочетаются с такими врожденными дисплазиями, как диспигментация кожи, гипоплазия почек и селезенки, отсутствие или гипоплазия лучевой кости, микроцефалия, врожденные пороки сердца и умственное или половое недоразвитие. Кариологические исследования при этом варианте АА часто выявляют различные хромосомные нарушения. Среди детей с анемией Фанкони отмечается также высокая частота заболеваемости острым лейкозом и другими неоплазиями.
При вторичных АА костномозговая недостаточность обусловлена либо прямым токсическим воздействием радиации или химических соединений на стволовые клетки, либо аберрантным ответом, обусловленным вирусными инфекциями (гемофагоцитарный синдром). Наиболее частыми заболеваниями, провоцирующими развитие АА, являются злокачественные заболевания, заболевания крови (лимфопролиферативные заболевания), системные коллагенозы. Увеличение периферических лимфоузлов, печени и селезенки не характерно дляАА. Более того, обнаружение увеличенной селезенки на ранней стадии заболевания ставит под сомнение диагноз АА, свидетельствует в пользу гепатит-ассоциированной аплазии. Однако, длительное течение заболевания может сопровождаться увеличением печени и селезенки вследствие посттрансфузионного гемосидероза. В случаях с выявленной причиной АА, такое состояние необходимо рассматривать, как вторичную аплазию кроветворения.
Истинной (идиопатической приобретенной) АА является состояние, связанное сгибелью неизмененных стволовых клеток. При идиопатических формах, при которых причина, обусловившая аплазию костного мозга неясна, предполагается Т-клеточно-опосредованная деструкция полипотентных стволовых гемопоэтических клеток костного мозга. У больных с идиопатической формой АА в крови обнаружено повышенное количество активированных цитотоксических Т-лимфоцитов, повышенная выработка γ-интерферона и фактора некроза опухоли, которые вызывают гибель собственных стволовыхклеток костного мозга. Причем причина аутосенсибилизации Т-лимфоцитов противсобственных стволовых клеток остается неясной.
Классификация апластических анемий.
1. Идиопатические апластические анемии
— врожденная (анемия Фанкони)
— приобретенная
2. Вторичные апластические анемии, вызванные:
— лекарственными препаратами (хлорамфинекол, нестероидные противовоспалительные препараты, противосудорожные средства, цитотоксические препараты)
— вследствие воздействия ионизирующей радиации
— химическими воздействиями (бензол и его производные, пестициды, лакокрасочные материалы)
— вирусными инфекциями (Эпштейн-Барр, гепатиты, парвавирус, цитомегаловирус, ВИЧ)
— аутоиммуными заболеваниями (СКВ, эозинофильный фасциит, гипериммуноглобулинемия)
— другими причинами (беременность, тимома)
Клиника АА
Все клинические проявления АА являются следствием костномозговой недостаточности, интенсивность их зависит от выраженности и скорости прогрессирования панцитопении.Течение АА может быть острым, подострым и хроническим.
У больных АА обычно имеется анемический синдром в сочетании с геморрагиями на коже, слизистых оболочках и инфекционными осложнениями. Доминирующие симптомы АА отличаются в зависимости от сроков развития заболевания.
Известно, что эритроциты циркулируют в периферической крови в течение 3 – 4 месяцев, поэтому симптомы анемии могут развиваться только при длительном угнетении кроветворения более 1 – 2 месяцев. В результате продолжительного отсутствия продукции эритроцитов происходит постепенное снижение концентрации гемоглобина на 25 – 50%, то есть до 90 – 70 г/л, что может быть причиной появления симптомов анемии.
Наоборот, при быстрой гибели подавляющего числа стволовых клеток уже через неделю истощается гемопоэз, прекращается продукция тромбоцитов и лейкоцитов, а количество циркулирующих эритроцитов остается нормальным. Далее ещё в течение недели происходит снижение количества тромбоцитов, что приводит к появлению геморрагического синдрома, на фоне полного отсутствия анемических жалоб. До появления кровоточивости организм компенсирует недостаток тромбоцитов за счет имеющихся, которые в норме жизнеспособны в среднем 10 – 11 суток. Причем, снижение тромбоцитов в циркуляции происходит раньше на несколько дней, чем появление геморрагий, так как основное их количество представлено пристеночным пулом, который составляет основную массу тромбоцитов периферической крови и расходуется медленнее. Геморрагический синдром при тромбоцитопении связан с неадекватной трофикой и повреждением эндотелия, повышенной ломкостью мелких сосудов и проявляется кровоточивостью слизистых (носовые, маточные кровотечения), петехиальными высыпаниями на коже. Считается, что угрожающим для жизни состоянием является кожный геморрагический синдром на верхней половине туловища, особенно на лице, при котором резко повышается риск кровоизлияния в головной мозг.
Что касается лейкоцитов, в особенности нейтрофилов, то их количество снижается наиболее интенсивно. Срок жизни гранулоцитов не более недели, причем в периферической крови они циркулируют несколько дней, затем поступают в окружающие ткани, где осуществляют основную фагоцитарную функцию. Поэтому даже на фоне полного отсутствия нейтрофилов в периферической крови (агранулоцитоза) инфекционные осложнения наступают не сразу, а, как правило, через 5 – 7 дней, и имеют свои особенности. У таких больных часто имеет место высокая лихорадка при отсутствии источника инфекции. Так, при одышке не удается прослушать хрипы, при болях в животе крайне размыты симптомы раздражения брюшины. Для установки диагноз пневмонии и перитонита в таком случае крайне важны инструментальные методы исследования (рентгенологические и ультразвуковые), при использовании которых можно увидеть инфильтрацию ткани легких, появление уровней жидкости в кишечнике при его атонии, утолщение стенки кишки и другие. У больных с агранулоцитозом при появлении лихорадки крайне высок риск развития септического шока в связи с отсутствием барьерной функции лейкоцитов. Такие больные при развитии лихорадки в обязательном порядке нуждаются в исследовании крови на стерильность. Мало того, диагноз сепсиса при агранулоцитозе может устанавливаться даже вопреки классическому определению сепсиса, то есть без наличия «первичного очага». Наиболее частой причиной сепсиса при агранулоцитозе является «нормальная» флора кишечника (сапрофиты или условно патогенные бактерии).
При остром течении АА имеют место бурно прогрессирующий геморрагический синдром, обусловленный глубокой тромбоцитопенией, и тяжелые инфекционные осложнения вследствие почти полного отсутствия гранулоцитов. Больные с подобным течением АА, требуют экстренной госпитализации в гематологическое отделение и проведение антибактериальной, заместительной, часто интенсивной терапии, специализированного лечения. Без адекватной помощи, такие пациенты, как правило, погибают в течение нескольких дней или недель от появления первых признаков заболевания.
При среднетяжелом (подостром) течении АА слабость и повышенная утомляемость длительно остаются основными жалобами больного, затем из-за тромбоцитопении могут появиться симптомы геморрагического диатеза.
Для вторичных АА, которые клинически могут проявлять себя спустя недели и даже месяцы после контакта с этиологическим фактором, более свойственно хроническое течение. При вторичной АА чаще, чем при идиопатической форме, развивается ремиссия заболевания и может наступить полное выздоровление после прекращения действия этиологического фактора.
Лабораторные данные
Картина периферической крови у 90% больных АА характеризуется панцитопенией: анемией, лейко- и тромбоцитопенией.
Анемия носит нормохромный характер. Число ретикулоцитов снижено до 0 – 0,3%.
Лейкопения обусловлена гранулоцитопенией, причем содержание лимфоцитов обычно не изменено, что создает впечатление лимфоцитоза, который при АА носит относительный характер. Выраженность лейкопении во многом определяет тяжесть течения заболевания: число лейкоцитов < 0,5 х 109/л наблюдается больных с тяжелой АА, число лейкоцитов < 0,2х109/л – при сверхтяжелой АА.
Тромбоцитопения обнаруживается уже на ранних этапах заболевания и является наиболее стойким гематологическим симптомом.
Пунктат костного мозга в подавляющем большинстве случаев очень беден, т.е. содержит небольшое количество гемопоэтических клеток, большинство из которых – лимфоциты. Однако, поскольку процесс аплазии костного мозга происходит неравномерно и отдельные очаги нормального кроветворения сохраняются, можно получить деятельный костный мозг с почти нормальным клеточным составом (при панцитопении в анализе периферической крови!). Все это позволяет сделать заключение о том, что миелограмма при АА не имеет определяющего диагностического значения.
Ключевым методом для диагностики АА у взрослых является гистологическое исследование костного мозга. Для проведения этого исследования проводят трепанобиопсию, результаты которой при АА говорят о тотальном преобладании жировой ткани над деятельным костным мозгом.
При биохимическом исследовании крови у большинства больных АА выявляется высокий уровень сывороточного железа, повышение уровней ЛДГ и трансаминаз, повышенное содержание эритропоэтина.
Диагноз АА основывается на сочетании панцитопении периферической крови, снижении клеточности костного мозга при стернальной пункции и обнаружении жирового костного мозга при его гистологическом исследовании, при этом исключаются другие причины развития аплазии кроветворения.
Критерии панцитопении: Hb< 110 г/л, гранулоциты < 2,0 х109/л, тромбоциты < 100 х109/л.
Классификация АА по степени тяжести указана в таблице.
Классификация АА по степени тяжести
| Форма заболевания | Критерии |
| Нетяжелая АА | — пациент не отвечает критериям тяжелой и сверхтяжелой форм; — гранулоциты > 0,5 х 109/л. |
| Тяжелая АА | — гранулоциты < 0,5 х 109/л; — тромбоциты < 20 х 109/л. |
| Сверхтяжелая АА | — гранулоциты < 0,2 х 109/л. |
Как видно из таблицы, тяжесть АА определяется не концентрацией гемоглобина, учитывает только тяжелую тромбоцитопению, а основным фактором, определяющим тяжесть состояния больного, является уровень нейтрофилов в периферической крови. Это связано с имеющейся возможностью протезировать эритроцитарную и тромбоцитарную функцию переливанием эритроцитарной и тромбоцитарной массы, получаемых от доноров, и отсутствием методов коррекции нейтропении.
Дифференциальный диагноз
АА иногда приходится дифференцировать с заболеваниями, которые могут сопровождаться панцитопенией:
— острые лейкозы;
— мегалобластная анемия;
— идиопатический миелофиброз;
— гиперспленизм;
— миелодиспластический синдром (МДС).
При острых лейкозах с гипоплазией кроветворения, в отличие от АА, в костном мозге обнаруживаются на фоне костномозговой гипоплазии скопления бластных клеток, а при мегалобластных анемиях – мегалобластическое кроветворение.
У больных с идиопатическим миелофиброзом и гиперспленизмом почти всегда присутствует выраженная спленомегалия, которая всегда отсутствует при АА. Кроме того, при трепанобиопсии в первом случае выявляется миелофиброз, а во втором – костномозговая гиперплазия.
Сочетание панцитопении и костномозговой гипоплазии может наблюдаться у 10% больных с миелодиспластическим синдромом. Однако, при МДС, наряду с гипоплазией кроветворения, присутствуют его диспластические черты в виде мегалобластоидности, наличия двуядерных эритробластов, телец Хавелла – Жолли, сидеробластов (эритроцитов, содержащих гранулы железа), иногда – увеличенное содержание бластных клеток, а также присутствие Пельгеровской аномалии гранулоцитов (нарушение сегментации ядра) и микроформ мегакариоцитов. Кроме того, при МДС, как правило, обнаруживаются хромосомные нарушения, которые отсутствуют при АА.
Лечение
Единственным методом лечения больных АА, обеспечивающим высокую выживаемость (78 – 90%) и даже полное выздоровление больных, является аллогенная трансплантация костного мозга (АТКМ).
АТКМ от HLA-совместимого донора считается методом выбора у больных АА, если они отвечают следующим критериям:
1. наличие HLA-совместимого родственного донора костного мозга;
2. тяжелая или сверхтяжелая форма АА;
3. возраст больного не старше 40 лет;
4. короткий гемотрансфузионный анамнез.
В качестве родственных доноров используются,как правило, только родные братья и сестры.
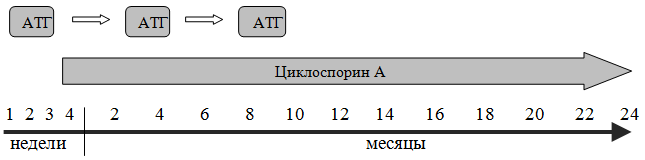
Стандартный мягкий режим подготовки больного (кондиционирования) к трансплантации костного мозга включает применение циклофосфана в дозе 50 мг/кг с –5 по –2 дни, антилимфоцитарного глобулина (АЛГ) с –5 по –3 дни и метилпреднизолона с –5 по –3 дни. Основной целью такого кондиционирования является иммуносупрессия, направленная на предотвращение отторжения трансплантата, которое при такой схеме снижается с 30% до 5%.
В качестве посттрансплантационной иммуносупрессии, направленной на подавление «реакции трансплантат против хозяина» (РТПХ), которая наблюдается как в острой форме, так и хронической (чаще), используется циклоспорин А в дозе 5 мг/кг в сутки в течение 12 месяцев в сочетании с короткими курсами метотрексата по 15 мг/м2 в +1, +3, +6, +11 дни.
Такая же схема кондиционирования и профилактики РТПХ применяется при использовании костного мозга HLA-совместимых неродственных доноров. Однако, трансплантация костного мозга от неродственных доноров дает значительно худшие результаты: только 29% больных АА были живы через 2 года после неродственной трансплантации.
Важное значение в эффективности трансплантации костного мозга имеют предшествующие гемотрансфузии: у больных, не получавших гемотрансфузии в 80% случаев удается получить полную ремиссию с пятилетней выживаемостью около 70%, тогда как у больных с сенсибилизирующей гемотрансфузионной терапией полная ремиссия достигается только в 50% случаев.
Опыт лечения АА введение гемопоэтических клеток выявил преимущество трансплантации костного мозга над использованием мобилизированных стволовых клеток, полученных из периферической крови донора.
Количество мононуклеаров при инфузии костного мозга должно быть не менее 3,0х109/кг при минимальном количестве CD 34+ стволовых клеток 2,6 х106/кг.
Исходя из предположения о роли супрессивного действия собственных сенсибилизированных Т-лимфоцитов на стволовые клетки костного мозга (с их последующим апоптозом), было предложено использование иммуносупрессоров с анти-Т-лимфоцитарным действием в лечении АА у больных. Таким :
— не имеющих HLA-совместимых доноров,
— больных с нетяжелой АА, которые зависят от гемотрансфузий,
— больных с тяжелой и сверхтяжелой формами АА старше 40 – 45 лет.
В качестве основной терапии АА используется схема с обязательным сочетанием патогенетического лечения (иммуносупрессивныепрепараты и спленэктомия), трансфузионной терапии и антимикробных препаратов.
Патогенетическое лечение
Чаще всего лечение начинается с антилимфоцитарного (антитимоцитарного) глобулина (АТГ: атгам, тимоглобулин). Препараты вводятся в/в медленно в течение 12 часов, после пробы на чувствительность, доза препарата составляет 20 мг/кг/cутки. Общее количество на курс составляет 4введения. Для профилактики сывороточной болезни используется преднизолон в дозе 1 мг/кг или метилпреднизолон 125 – 250 мг/сут (до и после АТГ) в сочетании с антгистаминными препаратами (до и после АТГ). С 14 дня курса (1 день курса отсчитывается с первого дня введения АТГ) необходимо отменять преднизолон. Отменяют его за неделю, постепенно уменьшая дозу (ежедневно на 1/3 – 1/2). Эффект от лечения АЛГ наблюдается у половины больных, причем в 15% достигаются полные ремиссии.
Вторым иммуносупрессором, который широко используется в лечении АА является циклоспорин А (СуА), который блокирует продукцию интерлейкина-2 (ИЛ-2), ответственного за пролиферацию цитотоксических Т-лимфоцитов.Применяется СуА в дозе 5 – 10 мг/кг в сутки при длительности курса не менее 12 месяцев. Во время приема СуА должны назначаться препараты магния (Магне В6, Магнерот), обязательно мониторироваться печеночные (билирубин, АЛТ, АСТ), почечные показатели (креатинин). Как и при использовании АЛГ, эффективность его составляет 50 – 60%, однако, по-видимому, этот препарат не обеспечивает достаточную иммуносупрессию и его отмена приводит к рецидиву заболевания.
В настоящее время наиболее часто используется комбинированная схема лечения, включающая введение АЛГ в течение 4 дней, а с 14 дня – применение СуА в течение 12 месяцев. Частота ответа на комбинированную терапию довольно высокая и достигает80% при тяжелой АА с пятилетней выживаемостью 75%. При неэффективности сочетанного использования АТГ + СуА возможно второе (через 3 – 6 месяцев) и третье (через 6 – 12 месяцев) введение АЛГ или замена одного курса АТГ спленэктомией.
Схема лечения апластической анемии (* — вместо АТГ возможно проведение спленэктомии)
При использовании АТГ нередко развивается сывороточная болезнь. Она проявляется у 50% больных спустя 5 – 14 дней после окончания введения препарата сыпью, артралгиями, лихорадкой, лабораторными признаками гепатита, подъемом артериального давления. В таких случаях целесообразно назначать преднизолон в дозе 0,5 – 1 мг/кг до купирования симптомов, при отсутствии эффекта или выраженных симптомах сывороточной болезни проводят плазмаферез.
Трансфузионная терапия
В последние годы у больных, ответивших на терапию АЛГ+СуА, производится спленэктомия, которая обнаружила свое положительное действие еще до внедрения в практику иммуносупрессивных средств.
Поддерживающая (заместительная) терапия, обеспечивающая удовлетворительное качество жизни больных, имеет большое значение в терапии апластической анемии:
1. Эритроцитарную массу следует переливать при снижении гемоглобина до 80 г/л, когда у больных обычно появляются симптомы тканевой гипоксии.
2. Показанием к переливанию тромбоцитарной массы являетсяснижение числа тромбоцитов менее 20 х 109/л или геморрагический синдром в виде кровоточивости слизистых и/или в сочетании с высыпаниями на коже верхней половины туловища (на фоне лечения АТГ трансфузии необходимо проводить при уровне тромбоцитов 40 – 60 109/л).
Трансфузий компонентов крови следует избегать в тех случаях, когда у больного имеются HLA-совместимые родственники и предполагается проведение трансплантации костного мозга. Этим предотвращается сенсибилизация больных и уменьшается риск отторжения трансплантата. Длительная гемотрансфузионная терапия приводит к развитию гемосидероза, поскольку в пакете эритромассы содержится 200 – 250 мг железа.
Для борьбы с посттрансфузионным гемохроматозом, усугубляющим костномозговую недостаточность и способствующего развитию цирроза печени и поджелудочной железы, используется хелаторная терапия. Её начинают при увеличении ферритина сыворотки> 1000 мкг/л. Основными препаратами, образующими комплекс с железом в крови и выводящими его с мочой, что препятствует развитию гемосидероза, являются десферал (дефероксамин) по 500 мг в день в/в (обычно используется на фоне гемотрансфузий или раз в неделю), а также новый, выводящий избыток железа препарат эксиджад (деферазирокс), который удобен способом приема – внутрь по 20 мг/кг/сутки.
Антимикробная терапия
У больных с тяжелой гранулоцитопенией (< 0,5х109/л) назначается КСФ, стимулирующий гранулоцитопоэз, но не влияющий на другие ростки кроветворения.
Больным АА с глубокой нейтропенией и лихорадкой показана терапия антибиотиками широкого спектра действия под контролем бактериологического исследования крови и мочи, обязательна изоляция больных в стерильные палаты. Антибиотики необходимо назначать при снижении нейтрофилов ниже 0,5 х 109/л всем больным, причем при нормальной температуре использовать профилактические дозы, при подъеме выше 37,5 0С – использовать цефалоспорины 3-его и 4-ого поколения, только максимальные лечебные дозы.
В случае отсутствия эффекта от антибиотической терапии у лихорадящих больных обязательно проводится обследование на аспергиллез (галактомонан в сыворотке крови), пневмоцистную инфекцию (бронхоскопия с бронхоальвеолярным лаважем – БАЛ), герпетическую инфекцию (ПЦР – в сыворотке крови). Даже при отрицательных результатах культуральных исследований применяются противогрибковые препараты: кетоконазол, флуконазол, интраконазол.
Под влиянием современной терапии период развернутых клинических проявлений может смениться состоянием клинико-гематологической компенсации и даже полной ремиссии, при которой исчезают все признаки болезни. В дальнейшем состояние клинико-гематологической ремиссии может смениться рецидивом заболевания. Полное выздоровление наблюдается у 15 – 50% больных АА, после аллогенной трансплантации костного мозга.
Оценка эффективности терапии проводится через 3, 6, 9, 12, 18, 24 месяца от начала терапии:
Ремиссия (полная, частичная)– полная нормализация, частичная нормализация показателей крови (Hb> 100 г/л, гранулоциты > 1,5 х 109/л, тромбоциты > 100 х 109/л) и отсутствие зависимости от гемотрансфузий.
Клинико-гематологическое улучшение – улучшение показателей крови (Hb> 80 г/л, гранулоциты > 1,0 х 109/л, тромбоциты > 20 х 109/л) и отсутствие или уменьшение зависимости от гемотрансфузий.
Течение и прогноз
До использования трансплантации костного мозга и иммуносупрессивной терапии 25% больных АА умирали в течение 4-ех месяцев от момента диагностики заболевания, а менее половины жили больше года. Трансплантация костного мозга приводит к значительному улучшению прогноза при АА и излечению 80% больных, не получавших трансфузии компонентов крови и 60% больных, которым трансфузии производились. Иммуносупрессивная терапия вызывает полную или частичную ремиссию у половины больных, однако у части из них (15%) развивается рецидив заболевания. Более того, на фоне почти десятилетней полной ремиссии заболевания, у 40% больных имеющийся дефект стволовой клетки может проявиться развитием пароксизмальной ночной гемоглобинурии, миелодиспластического синдрома или острого миелобластного лейкоза.
При диагностике заболевания прогноз во многом зависит от абсолютного числа нейтрофилов и тромбоцитов. Исключительно плохой прогноз у больных с постгепатитной аплазией.